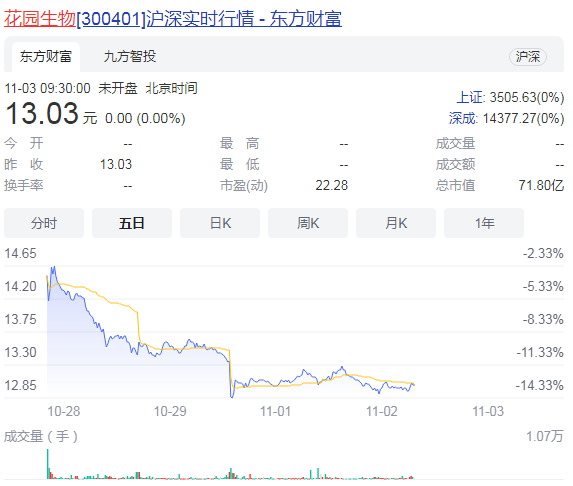
8月31日,復星醫藥開盤大跌,最低價報28.22元,較昨日收盤價跌幅10%。復星醫藥控股子公司重慶醫藥工業研究院(重慶醫工院)被舉報一事遭到媒體廣泛關注。復星醫藥昨日晚間發布公告稱,重慶食藥監局已就該信件所反映的內容開展相關調查,飛行檢查的結果尚待結論性意見。8月31日早7點重慶食藥監局官網更新舉報信稱,正在對重慶醫工院展開深入調查。
8月31日上午,新京報記者致電復星醫藥,公司回應記者稱,“我們內部看是沒有任何問題的,可能近期根據監管機構的反饋看是否做最新的公告”。記者致電重慶市食藥監局,相關工作人員回應記者稱,已經組織工作組對重慶醫工院進行調查,“調查的情況我們會及時公開”。
8月30日晚間,復星醫藥發布公告對舉報信內容做出回應稱,重慶食藥監局已就舉報信件所反映的內容開展相關調查,并已于2018年8月23日對重慶醫工院進行了飛行檢查,飛行檢查的結果尚待結論性意見。
8月24日,重慶市食品藥品監督管理局的官網上公布一則公開信,其中舉報人直言重慶醫工院存在“幾乎所有生產工藝都沒有根據批準的工藝生產”、“領導帶領員工大量編造生產記錄、檢驗記錄”、“欺騙上級藥品監督管理部門,騙取藥品GMP證書”等行為。
復星醫藥持有重慶醫工院56.89%的股權。新京報昨日報道,重慶醫工院在2017年3月收到FDA針對2016年5月16日至19日對重慶醫工院南岸區涂山路工廠QC實驗室原料藥檢查中所發現的實驗室數據規范性不足出具的警告信。”事情過去1年半以后,重慶醫工院的警告仍未能解除。
對于此前遭FDA進行警告,8月31日復星醫藥回應記者稱“這已經是過去的事情,我們已經處理完了”。
8月30日晚間,復興醫藥稱,針對當時的整改要求,公司已對重慶醫工院時任主要領導及相關責任人員進行了嚴肅處理調整,并在積極推進相關整改工作,力爭盡快通過FDA現場檢查。
復星醫藥披露,2017年11月,FDA再次針對醫工院制藥(長壽區新場地)的質量體系進行批準前檢查。檢查后對于原料藥阿立哌唑提出一條483缺陷,該缺陷主要針對阿立哌唑檢測時所產生的無效OOS(偏差調查)不充分。目前,醫工院制藥已經在FDA的規范指引下展開整改。